آیا استون در آب حل می شود؟
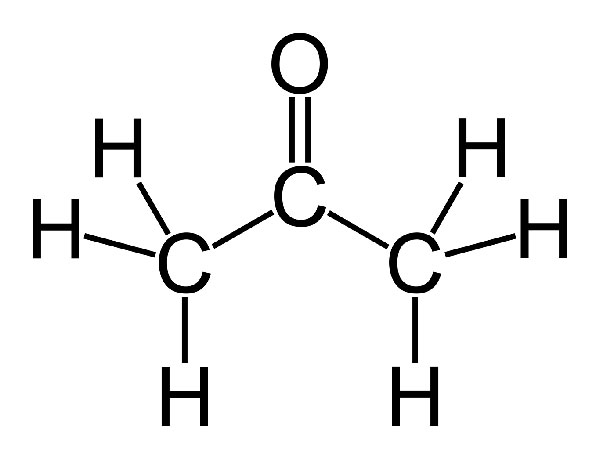
استون یا پروپانول در گروه کتون ها قرار دارد و به شکل مایعی بی رنگ و دارای بو در محیط ظاهر می شود..
استون به راحتی در بسیاری از حلال ها همچون اتانول، اتر و آب حل می شود.
در این مطلب به چگونگی حل شدن استون در آب می پردازیم.
حلالیت نقش مهمی در شیمی آلی دارد و کاربردهای آن گسترده است، از خالص سازی (استخراج) تا شناسایی ترکیبات ناشناخته، این دومی است که مورد بحث قرار خواهد گرفت.
استفاده از حلالیت به عنوان وسیله ای برای شناسایی، از ویژگی های مرتبط با گروه های عاملی خاص بهره می برد، در حالی که ساختار شیمیایی دقیق را تعیین نمی کند، همانطور که تکنیک های طیف سنجی انجام می دهند، یک ایده تقریبی از گروه های عاملی کلیدی موجود و درجه خصوصیات هیدروکربنی ارائه می دهد.
حلالیت چیست؟
حلالیت را می توان به عنوان حداکثر مقدار حل شده ای که می تواند در مقدار ثابتی از حلال در یک دمای خاص حل شود تعریف کرد. املاح ماده محلول است در حالی که ماده حل کننده حلال است.
چه چیزی "حل شده یا Dissolved" در نظر گرفته می شود؟
هنگامی که یک محلول همگن و بدون ذرات معلق تشکیل شود، یک ماده حل شده "محلول" در نظر گرفته می شود. اگر املاح مایع باشد، نباید لایه های قابل تشخیصی بین املاح و حلال وجود داشته باشد. (نکته آزمایشگاهی: هنگام بررسی حلالیت، یک ورق کاغذ تیره را پشت لوله های آزمایش قرار دهید.)
چگونگی حل شدن استون در آب
مولکول های استون دارای یک گروه کربونیل قطبی هستند که به آنها اجازه می دهد پیوندهای هیدروژنی را از سایر ترکیبات بپذیرند. هیچ پیوند قطبی C-H یا O-H روی استون وجود ندارد. بنابراین، نمی تواند پیوند هیدروژنی با سایر مولکول های استون ایجاد کند. نیروهای درون مولکولی از نیروهای پراکندگی تشکیل شده است.
از سوی دیگر، آب دارای دو پیوند O-H قطبی است. بار مثبت هر هیدروژن می تواند اتم های اکسیژن کمی منفی را روی مولکول های دیگر آب جذب کند و پیوندهای هیدروژنی تشکیل دهد.
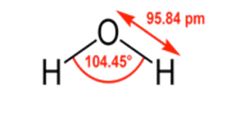
چرا اگر استون به آب اضافه شود، استون کاملا حل می شود.
چرا که گروه کربونیل موجود در استون می تواند پیوندهای هیدروژنی (بسیار قوی تر از نیروهای پراکندگی) ایجاد کند. هیچ تغییری در نوع یا مقدار پیوند هیدروژنی که از منظر آب اتفاق می افتد وجود نخواهد داشت. این منجر به برهمکنش مطلوبتر حلال و حلال میشود، بنابراین استون وارد محلول میشود.
درباره ما
شركت مينا تجهيز آريا با سالها تجربه و با استفاده از تخصص،تعهد، تجربه و دانش هاي نوين اقدام به تهيه، توزيع مواد شیمیایی ( آزمایشگاهی ، صنعتی ) و تجهيز لوازم آزمايشگاهي، شيشه آلات و كليه ملزومات آزمايشگاهي از شركت هاي داخل و خارج كشور نموده است.
برای پرسش و پاسخ و دریافت قیمت و موجودی با کلیک روی لینک زیر به تلگرام شرکت پیام دهید
آدرس : تهران - میدان توحید- خیابان امیر لو(نبش کوچه خودرو) - پلاک 42- طبقه دوم - واحد5
ایمیل : minatajhiz_aria@yahoo.com
شماره ها تماس : 02166901187 - 02166900058
شماره های همراه :09362048289 - 09927282910
شماره های واتس آپ ، ایتا ، تلگرام و روبیکا : 09927282910

